Posted by : Unknown
miércoles, 23 de noviembre de 2016
2.3.4 LAS RADIACIONES DEL SOL Y SMOG FOTOQUÍMICO
¿CÓMO SE FORMA EL SMOG FOTOQUÍMICO?
El monóxido de nitrógeno (u óxido nítrico) se forma cuando el oxígeno y el nitrógeno atmosféricos reaccionan a altas temperaturas. Esta reacción se da, por ejemplo, en los motores de combustión de los automóviles de la siguiente forma:

Sin embargo, el óxido nítrico es una molécula altamente inestable en el aire, ya que se oxida rápidamente en presencia de oxígeno, convirtiéndose en dióxido de nitrógeno según la reacción:

Entre los compuestos orgánicos volátiles (COVs) se encuentran los hidrocarburos no quemados que pueden ser emitidos también por vehículos, así como disolventes o combustibles que se pueden evaporar fácilmente. También éstos pueden provenir de zonas arbóreas, al emitirse de forma natural hidrocarburos, principalmente isopreno, pineno y limoneno.
Los contaminantes secundarios, formados a partir de los anteriores, a través de una serie compleja de reacciones propiciadas por la radiación solar, son el ozono, el HNO3, el nitrato de peroxiacilo (PAN) y otros compuestos.
Reacciones
Durante el día el dióxido de nitrógeno se disocia en monóxido de nitrógeno y radicales oxígeno:
NO2 + hν → NO + O·
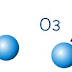
El O· se combina con oxígeno molecular generando ozono:
O· + O2 → O3
En ausencia de COVs este ozono oxida al monóxido de nitrógeno de la etapa anterior:
O3 + NO → O2 + NO2
Pero en presencia de COVs, éstos se transforman en radicales peroxi que a su vez oxidan al NO:
ROO· + NO → RO· + NO2
De esta forma el NO no está disponible para reaccionar con el ozono y éste se acumula en la atmósfera.
Muchos de los radicales RO· generados terminan formando aldehídos. Éstos, cuando la concentración de NO es baja (conforme avanza el día), pueden reaccionar con NO2 dando lugar a compuestos del tipo RCOOONO2 (cuando R es un metilo se denomina peróxido de acetilnitrato, PAN, un compuesto tóxico).
La formación del HNO3 se produce al final del día por reacción del NO2 con radicales oxhidrilo:
NO2 + OH· → HNO3
Durante la noche los radicales OH· pueden reaccionar con el NO dando ácido nitroso, que se disocia en presencia de luz, pero es estable durante la noche.
OH· + NO → HONO
HONO + hν → OH· + NO
Durante la noche las reacciones de smog fotoquímico se ven muy reducidas al necesitar la luz para funcionar, aunque éstas pueden continuar a través de otros compuestos.
IMPACTO EN EL AMBIENTE
Una de las consecuencias del smog sobre un área determinada es que afecta al clima de esa área. El smog reduce la cantidad de energía solar que llega hasta la superficie de la Tierra. En algunas ciudades, la reducción ha llegado a alcanzar 35% en días particularmente contaminados.
La reducción es todavía mayor cuando el Sol se está poniendo en el horizonte pues a medida que el águlo disminuye, la luz solar tiene que viajar por una mayor cantidad de aire contaminado.
La reducción en la radiación solar no es lo único que la contaminación altera. También puede alterar patrones de lluvia. Por lo general, las partículas en el aire se forman de la condensación del núcleo que atrae vapor de agua. Por ejemplo, cuando se acumula suficiente humedad alrededor de partículas de polvo, es común que esta mezcla caiga en forma de gotas de lluvia. Pero otros componentes de la contaminación del aire, como el carbón negro, son partículas muy pequeñas que no producen gotas de lluvia lo suficientemente grandes como para que puedan caer. Debido a que la lluvia limpia al aire de polvo, hollín y químicos contaminantes, la visibilidad atmosférica podría verse impactada negativamente.
 |
| http://cdn1-www.webecoist.momtastic.com/assets/uploads/2009/03/lasmog-468-x-262.jpg |
REFERENCIAS:
https://es.wikipedia.org/wiki/Esmog_fotoqu%C3%ADmico
http://cuidemos-el-planeta.blogspot.mx/2010/11/que-es-el-smog-fotoquimico.html
https://acmctema8.wikispaces.com/Smog+Fotoqu%C3%ADmico+e+Inversi%C3%B3n+T%C3%A9rmica